Nature Biotechnology 发布益杰立科最新研究:新型表观调节器在灵长类中实现高效、长期的降血脂治疗
2025年10月1日,公司在国际顶尖学术期刊《Nature Biotechnology》发表论文,题为“Design of optimized epigenetic regulators for durable gene silencing with application to PCSK9 in non-human primates”。该研究通过系统性优化表观遗传调控工具,开发出新型高效调节器EpiReg-T,在非人灵长类动物中实现了一次给药、长期稳定抑制PCSK9基因表达并降低“坏胆固醇”的显著疗效,为心血管疾病等代谢性疾病的治疗提供了潜在的全新策略。

表观遗传调控作为基因治疗领域的新兴方向,不改变DNA序列,而是通过调控基因的表观修饰来精准控制基因的“开启”或“关闭”,为基因治疗的安全性提供了新的思路。然而,该技术长期以来面临效果持久性不足的挑战,制约其临床转化。本研究团队通过对调节器元件与结构进行系统性优化,开发出效率显著提升的新型调节器。在细胞、小鼠及食蟹猴模型中直接比较证明,基于TALE蛋白的单组分表观调节器(EpiReg-T,结构更简单,递送效率更高)在低剂量下的药效,显著优于基于CRISPR/dCas9的双组分系统。在非人灵长类动物模型中,EpiReg-T仅需单次静脉给药,即可实现对血液中PCSK9和“坏胆固醇”的持续、深度抑制,在文章发表时,该疗效已稳定维持超过一年且未见反弹。本研究同时揭示了这种长效抑制是DNA甲基化与组蛋白修饰协同作用的结果,深化了对表观遗传分子机制的理解。
为打造一款性能最优的表观调节器,研究团队在小鼠体内对不同元件和结构的版本进行了系统性筛选。他们通过脂质纳米颗粒(LNP)将编码调节器的mRNA递送至肝脏,团队最终筛选出两个优胜版本:基于dCas9的 EpiReg-C 和基于TALE的 EpiReg-T。在与先前报道的基于锌指蛋白的表观调节器及碱基编辑器ABE8.8的“同台竞技”中,EpiReg-C和EpiReg-T均展现出显著的的效率优势(图1c)。随后,团队在多种模型中进一步对比了EpiReg-C和EpiReg-T。结果表明,虽然在饱和剂量下两者抑制效果相近,但EpiReg-T展现出更强的剂量敏感性,即在更低的剂量下就能达到强大的抑制效果。这一特性在非人灵长类动物也得到了验证(图1d)。
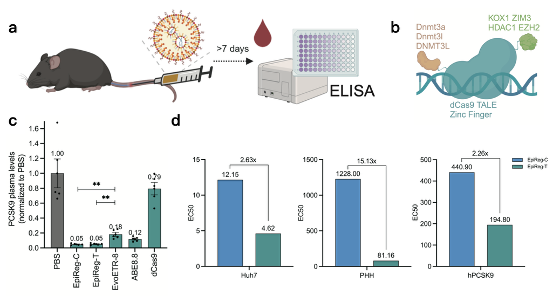
图1 EpiReg的筛选和对比
为了验证这种基因沉默能否在细胞更新换代中稳定“遗传”,研究团队进行了小鼠2/3肝切实验(图2a)。结果显示,即使在肝细胞快速再生后,PCSK9的抑制水平依然稳定如初(图2b)。此外,这种表观抑制还具有“可逆性”这一关键安全特性。在实现PCSK9的深度抑制后,注射一种表观激活工具,即可让其表达水平恢复至初始状态(图2c)。在最关键的非人灵长类动物实验中,高剂量(2.25mg/kg)的EpiReg-T单次给药便实现了约90%的PCSK9抑制和约60%的“坏胆固醇”降低,且在长达343天的持续跟踪中,药效依然稳定(图2d,e)。在分子机制层面,研究揭示了长效沉默的秘密,EpiReg-T在靶基因调控区域同时建立了两种抑制性“标记”——DNA甲基化和组蛋白H3K27e3修饰,而多种促进基因转录的激活型修饰(H3K4me3、H3K9ac和H3K27ac)显著下调(图2f,g)。
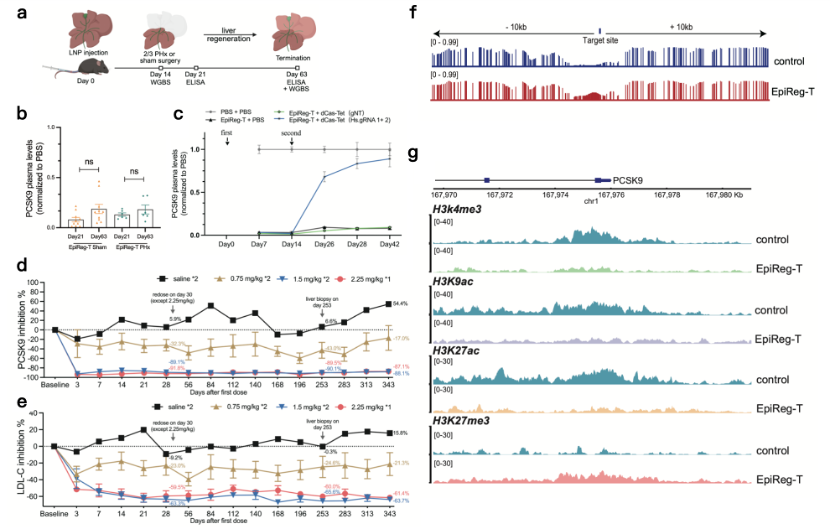
图2 EpiReg-T在小鼠和非人灵长类体内验证
在安全性方面,全基因组范围以及根据序列同源性预测的潜在脱靶位点测序分析证实, EpiReg-T即使在饱和剂量下也未引发显著的脱靶效应,展现了高度的靶向精确性。
该成果标志着表观遗传调控技术在向临床应用迈进的过程中取得了关键进展,展示了其在安全性、持久性和有效性方面的显著优势。公司未来将继续强化基因治疗创新平台的构建,加速突破性性科学成果的临床转化,为全球患者带来新的希望。



